Ca multe complexe de metale de tranziție, pentahidratul de sulfat de cupru (II) este viu colorat; cristalele acestei substanțe frumoase sunt o nuanță palidă de albastru. Culoarea sa provine din chimia și fizica compoziției sale - sau, mai precis, tipul de legături pe care le formează cu ionii de sulfat și moleculele de apă atașate de cupru.
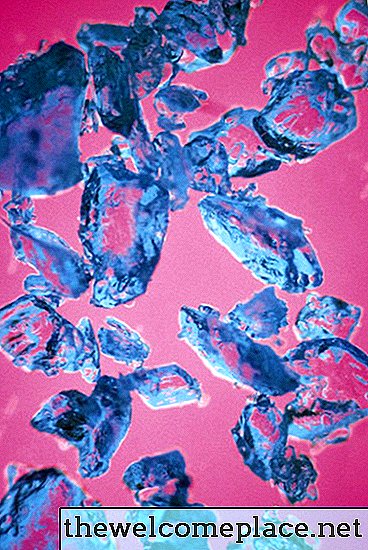
 Pentahidratul de sulfat de cupru are o culoare albastră translucidă.
Pentahidratul de sulfat de cupru are o culoare albastră translucidă.Orbitali
Electronii prezintă dualitatea undă-particule, ceea ce înseamnă că au atât proprietăți ca unda, cât și proprietăți asemănătoare particulelor. Comportamentul unui electron într-un atom este descris de o ecuație asemănătoare undelor numită funcție de undă. Pătratul funcției de undă oferă probabilitatea ca electronul să fie găsit la un moment dat, la un moment dat. Funcțiile de undă ale electronilor din atomi sunt de asemenea numite orbitale atomice. Chimiștii numesc orbitali atomici folosind un număr pentru a desemna nivelul de energie al orbitalului urmat de o literă pentru a desemna tipul de orbital. Pentru elementele din a patra perioadă a tabelului periodic sau de mai sus, trebuie să vă concentrați doar pe trei tipuri de orbitale, și anume s, p și d. Pentru a înțelege forma acestor orbitale, consultați linkul din secțiunea resurse.
Împărțirea câmpului de cristal
Ionul de cupru din sulfat de cupru (II) a pierdut doi electroni, deci are o încărcare de +2. Are nouă electroni în nivelul său extern de energie sau înveliș; acești așa-numiți electroni de valență ocupă toți orbitalii 3d. Moleculele de apă și ionii de sulfat sunt atrași de încărcarea pozitivă a ionului de cupru, astfel încât se apropie de ea și se aranjează în jurul acesteia într-o configurație octaedrică. În consecință, două dintre cele cinci orbitale 3d ale ionului de cupru se aliniază de-a lungul axelor prin care se apropie ionii de sulfat și moleculele de apă; de vreme ce electronii din aceste orbitale și electronii din molecule / ioni au ambii sarcină negativă, ei se resping reciproc. În cele din urmă, două dintre cele cinci orbitale 3d au crescut energia; acestea se numesc de exemplu orbitale. Celelalte trei, în schimb, au scăzut energia și sunt numite orbitale t2g.
Absorbția luminii
Un foton de lumină va fi absorbit de complexul de coordonare dacă are o energie echivalentă cu diferența dintre starea pe care o ocupă acum un electron și energia unui alt stat de care dispune. În consecință, complexul de sulfat de cupru poate absorbi fotoni de lumină cu energii echivalente cu diferența de energie între t2g și de exemplu orbitali. După cum se întâmplă, diferența de energie pentru complexul de sulfat de cupru este echivalentă cu diferența de energie pentru fotoni de lumină în regiunea roșu-portocalie a spectrului. Deoarece lumina roșiatică este absorbită în timp ce se transmite lumină albastră, sulfatul de cupru apare albastru.
Dizolvarea în apă
Când sulfatul de cupru se dizolvă în apă, ionii de cupru și sulfat se dizolvă. Acum ionul de cupru formează un complex octaedric unde este înconjurat de șase molecule de apă. Efectul este totuși același, totuși, deoarece împărțirea între orbitalii t2g și de exemplu orbitalii din acest nou complex este încă astfel încât lumina de culoare portocaliu să fie absorbită și vedeți o soluție de culoare albastră.